科技日报记者 张梦然
蛋白质结构及其折叠的空间究竟有多大?大自然是否“探索”了所有这些可能?一项开创性的研究为人们提供了新线索:日本研究人员着手揭示大自然在多大程度上探索了可能的蛋白质拓扑空间,结果发现了一系列令人震惊的前所未知的蛋白质折叠,扩大了人们的理解并揭示了“蛋白质宇宙”的深度。该研究发表在最新一期《自然·结构与分子生物学》杂志上。
图片来源:《自然·结构与分子生物学》
虽然实验技术已解开了许多蛋白质的结构,但由α螺旋和β链的排列和连接性定义的新蛋白质折叠的发现却变得越来越罕见。这就提出了一个问题:大自然未探索到的蛋白质折叠空间有多大?科学家们虽进行了理论研究,但缺乏实验验证。
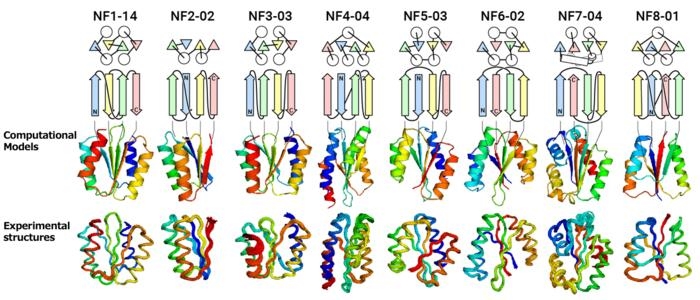
为了解决这个长期存在的问题,日本理化学研究所、大阪大学、名古屋大学等机构的联合团队根据物理化学和蛋白质结构数据设计了规则,从理论上预测可能的蛋白质折叠,然后使用这些规则来预测新的αβ折叠,该折叠由4—8个链β折叠组成。结果识别出12356个新折叠,是目前的蛋白质数据库中没有的。然后,该团队尝试从头开始通过计算设计预测的新折叠蛋白质,以评估其可折叠性和保真度。
实验测试的结果令人惊讶。对于所有折叠,计算设计的蛋白质结构与实验结构非常匹配。这些发现表明至少存在大约10000个未探索的可折叠αβ折叠,考虑到自然界中仅观察到400个αβ折叠,这是一个重要的启示,表明蛋白质折叠空间中许多潜在的折叠仍然未知。
这不但为功能性蛋白质分子的从头设计铺平道路,也引发了关于进化的理论假设。蛋白质可能是通过重复使用特定的折叠同时表达不同的功能而进化的。那么,如果外星生命确实存在,它也可能利用一组不同的蛋白质折叠。
-

ABC涉事产品仍在出售
近日,“卫生巾实际长度与标示长度不一”“偷工减料”一事引起广泛关注。
2024-11-22
-

老虎进村,90多岁村民称第一次听说,专家:伤人老虎或来自俄罗斯
11月18日,黑龙江省勃利县吉兴乡长太村发生一起老虎伤人事件,引发广泛关注。
2024-11-20
-

游客夜爬大牯牛山纵火烧山?当地已成立调查组
近日,一段“游客夜爬大牯牛山纵火烧山”的视频引发关注。
2024-11-19
-

一年盗水5千余吨,央视起底“免费洗车”背后的门道
《财经调查》记者在各地走访调查后发现,许多共享洗车场没有配备应有的循环水设备,反而将一次性洗车废水直接排入地下管网。更有一些洗车场为了获取廉价水源动起了歪脑筋。
2024-11-18








